抗癌药是药企研发的大热门,但在FiercePharma排出的2019年十大重磅上市新药中却没有抗癌药的身影,反而是免疫类药物与治疗罕见基因疾病的药物成为了焦点。
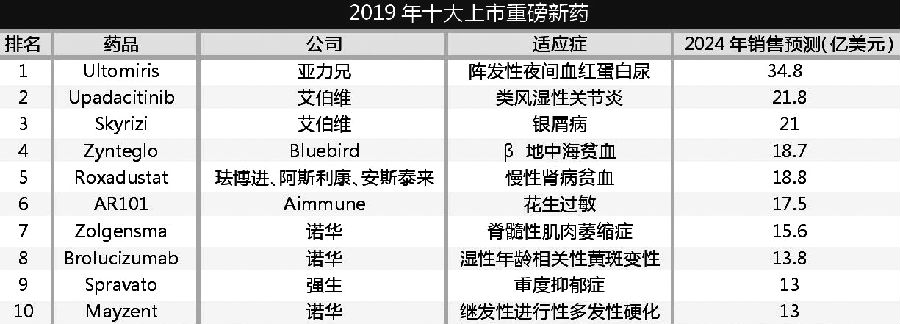
FiercePharma根据EvaluatePharma作出的2024年销售额预测,整理出了这份名单,其中,排在榜首的是亚力兄制药(Alexion)依库珠单抗(Soliris)的后续产品Ultomiris,该药在2018年年底获得了FDA批准。
值得注意的是,该榜单上有两种基因疗法:诺华(Novartis)治疗脊髓肌萎缩(SMA)的Zolgensma与Bluebird公司治疗β地中海贫血的Zynteglo。前者将与百健(Biogen)的Spinraza竞争SMA市场。
诺华有三种药物出现在该榜单上,数量最多。除了Zolgensma,该公司还有brolucizumab,该药用于治疗与年龄有关的湿性黄斑变性,将与拜耳(Bayer)和再生元(Regeneron)的阿柏西普(Eylea),以及其与罗氏(Roche)的雷珠单抗(Lucentis)竞争市场。在头对头研究中, brolucizumab的一些次要疗效终点指标超过了阿柏西普。
此外,诺华的Mayzent是首个用于治疗继发性进行性多发性硬化症(SPMS)的口服药物,于今年3月获得FDA批准。
在免疫学领域,艾伯维(Abbvie)有两个潜在的畅销药物——Skyrizi与Upadacitinb。该公司正试图使其产品线多样化,因为其在该领域的畅销药阿达木单抗(Humira)在美国以外的市场受到生物类似药竞争,销量开始下滑。
Aimmune公司的AR101也榜上有名,该药有望成为首个减少儿童对花生意外接触过敏反应的药物。
在这份榜单发表时,Bluebird公司披露Zynteglo会推迟上市。但FiercePharma决定不将其从榜中删除,因为该公司计划在年内招募病人,并在2020年初开始销售,治疗首批患者(图1)。
1.Ultomiris:肩负业绩新支柱重任。
亚力兄对Ultomiris寄予厚望,这是依库珠单抗的后续产品,目前,该公司正在大力推广该药。
亚力兄商业主管Brian Goff在第一季度的电话会议上透露,截至4月22日,该公司已将22%的阵发性夜间血红蛋白尿症(PNH)患者转为使用Ultomiris。这一数字与该公司高管一个月前公布的14%的使用率和2月初3%的使用率相比,有了显著的飞跃。
从这些数据看,亚力兄计划在2020年年底实现70%的病人转用Ultomiris的目标应该不成问题。该药强劲的初始表现让SVB Leerink分析师Geoffrey Porges对其实现这一目标保持乐观。
2.Upadacitinib:安全性疑虑存隐患。
尽管公司严重倚赖的阿达木单抗最终会迎来结束增长的时刻,但艾伯维的后劲不容小觑,今年上市的前3个重磅新药中有2个来自该公司。
Upadacitinib在该榜单上排名第二,用于中到重度的类风湿性关节炎。Cortellis公司分析师预计该药8月将在美国获批,10月在欧洲获批,其预测该药2024年的销售额为21.8亿美元。
不过,前路并非一帆风顺。每日口服一次的upadacitinib属于选择性JAK1抑制剂,而此类药物已经受到了严重不良反应的警告。在辉瑞(Pfizer)的Xeljanz的上市后安全性研究中,研究人员发现在大剂量下该药会增加患者的肺栓塞发生率。辉瑞因此将全部高剂量治疗的病人改为了较低的剂量,但这也让大家开始担心JAK抑制剂类药物的安全性。
事实上,Xeljanz并非唯一受到FDA安全警告的JAK抑制剂。在礼来的Olumiant的审批上,FDA只批准了小剂量规格上市,高剂量规格因为安全性问题没有获批。
在upadacitinib的临床研究中也出现了几个心血管不良反应事件,这类药物的潜在安全性问题可能会影响艾伯维的计划。
不过这些安全性问题是否会影响销售还有待观察。礼来最近指出,长期研究数据显示,高剂量的Olumiant并没有像FDA说的那样会增加深静脉血栓形成或肺栓塞的风险。
此外,艾伯维也希望扩大upadacitinib的适应症。其正在研究该药治疗克罗恩病、银屑病关节炎、过敏性皮炎、溃疡性结肠炎和中轴型脊柱关节炎的疗效。
3.Skyrizi:市场拥挤 竞争激烈。
今年4月,银屑病新药Skyrizi获得了FDA的批准。该药属于IL-23抗体,这一类别已上市的还有强生的Tremfya与太阳制药(Sun)的Ilumya。Porges指出,Skyrizi是这类药物中疗效最好的,将有利于该药的上市推广,其表示,该药的Ⅲ期临床研究结果出众,接受Skyrizi治疗的患者中,银屑病免疫及严重度指数(PASI)改善90%的患者比例达到75%左右。
艾伯维的优势不仅在于疗效上,与强生的产品相比,Skyrizi的使用非常便利。患者在第一次使用Skyrizi后,第二次用是4周后,此后的患者每年只需要注射4次;而强生的Tremfya需要每8周注射一次。
艾伯维还希望其定价策略能有助于蚕食Tremfya的市场份额。除银屑病外,Skyrizi还有很多其它的适应症前景,目前正在进行治疗克罗恩病、溃疡性结肠炎和银屑病关节炎的Ⅲ期临床研究。
事实上,除了IL-23抗体外,Skyrizi还有其他类型的竞争产品,包括IL-17抗体,如诺华的Cosentyx、礼来的Taltz和瓦兰特(Valeant)的Siliq;强生的抗IL-12/23药物Stelara、新基医药(Celgene)的银屑病口服药Otezla;以阿达木单抗为代表的抗肿瘤坏死因子抗体类药物。
4.Zynteglo:高药价问题待解。
Zynteglo不是直接提高血红蛋白水平来治疗β地中海贫血患者,而是针对这个疾病的潜在遗传原因。与其它旨在通过单次输注治疗复杂疾病的基因疗法一样,定价和药物可及性是该药面临的重大挑战。
Bluebird公司还没有宣布Zynteglo在美国市场的价格,但在6月初的一次投资者报告中,其在欧洲公布了这一价格:157.5万欧元(177万美元),5年内付清。6月3日,该药获得欧盟批准用于治疗输血依赖性β地中海贫血(TDT)。
Zynteglo是Bluebird的第一个商业化产品,作为一种创新疗法,其在上市前需要做很多工作。Bluebird首席商务官艾莉森·芬格(Alison Finger)表示,该药只是获得了有条件的上市,因此目前公司仍在与欧洲药品管理局(EMA)合作,以最终确定并简化该药的说明书,并建立商业药品生产流程。据其透露,Bluebird预计在今年年底前将患者纳入治疗中心,并在2020年初治疗第一名收费患者。
FDA预计将在2020年初对Zynteglo做出审评决定,与此同时,Bluebird正在积累新的数据来支持其功效。此外,其也对镰状细胞贫血患者研究该药的疗效。
5.Roxadustat:给药途径、安全性存优势。
罗沙司他(Roxadustat)在中国率先获批,由珐博进与阿斯利康(AstraZeneca)和安斯泰来(Astellas)合作开发。
罗沙司他是第一个获批上市的低氧诱导因子-脯氨酰羟化酶抑制剂(HIF-PHI)。在一项针对中国透析依赖患者的Ⅲ期临床研究中,采用给药后26周血红蛋白水平为疗效终点,该药与强生和安进的金标准Epogen/Procrit的疗效相当。
疗效不落后只是罗沙司他市场竞争前景的一部分,该药还有其它优势。首先,这是一种每周三次的口服药,而刺激因子类(ESA)药物是通过静脉或皮下注射的。以罗沙司他为代表的HIF-PHI药物也能增加铁的利用率,而ESA只刺激红细胞生成素。一些使用ESA的病人需要补充铁,并定期进行铁含量的检查。
Porges指出,罗沙司他的主要优势在于其心血管安全性。早在2000年,就开始有证据表明ESA与更高的心血管事件和肿瘤生长风险有关。随后,整个ESA类别的药物都加上了FDA的黑框警告,建议医生使用更保守的剂量。
罗沙司他在中国获批后可能很快扩展到更大的非透析依赖人群,这取决于其Ⅲ期临床研究的结果。该药在美国和欧洲的上市申请预计在今年提交,并计划在2020年上市。
6.AR101:有望成首个花生过敏药。
Aimmune公司的AR101有望成为首个减少过敏儿童对花生接触后过敏反应的药物,该药的原理是通过逐渐增加剂量的方式让患者接触花生过敏原,从而使其脱敏,能够耐受更高剂量的花生蛋白。
Aimmune强调,AR101不能治愈花生过敏,其目的是减轻意外暴露的风险。在纳入554名受试者的Ⅲ期研究Palisade中,超过2/3使用AR101的4~17岁患者能够耐受600毫克或更多的花生蛋白,而对照组为4%。
这些患者在开始进入试验时只能耐受100毫克的花生蛋白。在生活中,600毫克的蛋白质相当于两颗花生或一小口花生酱三明治。
虽然AR101的疗效没有问题,但其安全性数据存在一些疑问。在Palisade研究中,1/5的非成人患者因治疗相关的副作用退出研究。Aimmune的高管认为,中途停止治疗在真实世界中可能不是一个大问题,因为医生可以根据个人情况调整剂量的递增方法。
AR101在FDA的审评过程也并不顺利。Aimmune在去年12月提交上市申请后就遇到了美国政府关门事件,由于人手不足,FDA直到今年1月才接受申请。该公司表示,按照标准的12个月内完成审评,意味着AR101将在2020年1月底得到审评决定。但Aimmune正与FDA商讨缩短时间,因此该药仍有可能在今年上市。
7.Zolgensma:挑战SMA金标准。
Zolgensma是一种基因疗法,今年5月获批用于治疗2岁以下的SMA儿童。该药将挑战百健的Spinraza,后者于2017下半年批准上市,目前是治疗SMA的金标准,2018年销售额为17.2亿美元。Evaluate预测,2024年Zolgensma的销售额将达15.6亿美元。
诺华对Zolgensma设定的价格为212.5万美元,可分5年付清,每年的费用为42.5万美元。该公司指出,Zolgensma的总体花费只有Spinraza使用10年所需费用的一半。
不过,百健研发主管Michael Ehlers指出,Zolgensma的长期疗效数据还是有局限,目前只在15名病人中随访了2.5年,而Spinraza在超过300个患者中随访了6年。
8.Brolucizumab:AMD市场新竞争者。
再生元的阿柏西普与罗氏的雷珠单抗已经在湿性年龄相关性黄斑变性(AMD)治疗领域相互竞争,不久后其将迎来一个新对手。
今年4月,诺华的brolucizumab获得了FDA的优先审评资格,预计将在10月得到审评结果。诺华为此使用了一张优先审评券,这也显示出该公司对brolucizumab的上市十分热切。
诺华一位高管表示,该公司已经为即将到来的竞争摩拳擦掌,其已经在关键地区配备了相关人员。EvaluatePharma预测,到2024年,brolucizumab的销售额将达到13.8亿美元。
与此同时,罗氏与再生元也在准备迎接挑战。前者有自己的下一代AMD新产品faricimab,目前处于Ⅲ期临床研究阶段;而后者的阿柏西普新增了一个适应症,可用于治疗糖尿病视网膜病变。
9.Spravato:被强生寄予厚望。
作为鼻喷雾剂,Spavavo被批准与口服抗抑郁药一起使用,但该药仅限于那些尝试过两种不同抗抑郁药后还是无效的成年患者。由于其安全风险以及滥用和错用的可能性,FDA要求强生建立一个限制性的分销系统,患者只能在经过认证的治疗中心使用该药,不能在家服用。
在定价上,Spavavo较高剂量下治疗第一个月的费用为6785美元;之后,价格降至最高3450美元。
尽管Spravatos的使用受到限制,一些Ⅲ期临床研究没有获得预期结果,且其价格相对较高,强生(Johnson & Johnson)依旧对该药寄予厚望。该公司首席执行官Alex Gorsky将其与FGFR靶向抗肿瘤药Balversa列为强生两个前景看好的新药,将成为“重磅炸弹”。
Jefferies公司分析师曾预测Spravato的销售额可能达到30亿美元的峰值,Evaluate Pharma则预计到2024年,该药的销售额将达到13亿美元。
10.Mayzent:在已有基础上发力。
Mayzent的上市使其成为15年来首个专门为SPMS批准的新疗法,这令其拥有一个广阔的市场前景。多达80%的复发缓解型多发性硬化症患者会继续发展为SPMS,Mayzent每年的费用是88500美元。
不过,问题在于患者通常并不知道自己已经进展到了SPMS。诺华的挑战在于,首先让医生能够诊断出SPMS,并提高医生对该疾病治疗的认知。
诺华对这个领域并不陌生,其打算充分利用自己的经验。由于MS口服药芬戈莫德(Gilenya)的推广,该公司已经在MS治疗领域建立了很好的关系。
(选自《医药经济报》)