截止到2018年7月,由于当地政府和国际卫生组织的迅速干预,以及移动诊断实验室和有效疫苗的推出,从2018年4月开始的刚果民主共和国(DRC)爆发的埃博拉病毒,得到有效抑制。在限制病毒传播方面,针对一线医护人员以及受感染患者的环状疫苗接种,发挥了决定性作用。然而,这一乐观局面可能会被传统的葬礼习俗改变,在2013-2016年西非埃博拉病毒大爆发中,传统的葬礼习俗被证明在传播感染方面发挥了巨大的作用,是埃博拉病毒传播的超级传播事件。如果疫情再次升级,刚果民主共和国及其国际盟友将视疫情严重程度,根据同情使用方案启动5种在研药物(表1)给药方案。
表 1 埃博拉病毒在研药物
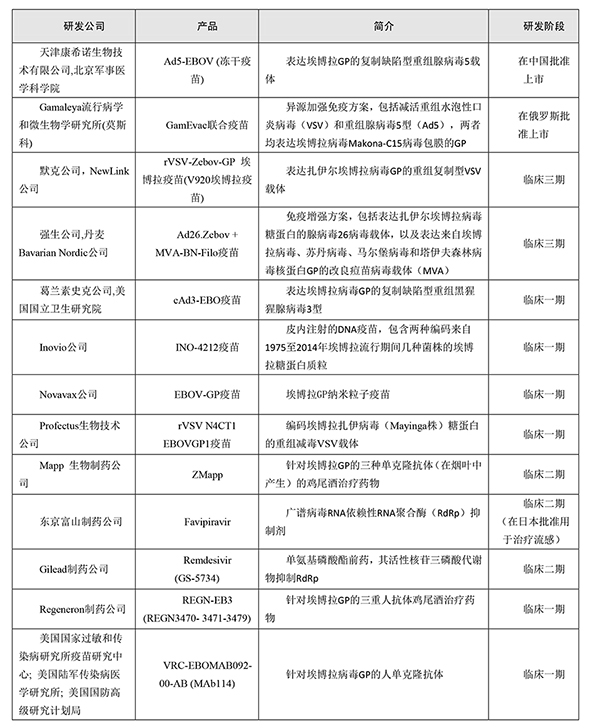
负责埃博拉病毒血清蛋白GP的抗体混合物,ZMapp生产商Mapp Biopharmaceutical(MappBio)公司总裁认为,这次疫情应对,比2013-2016年埃博拉病毒爆发时拥有更多更有效的选择方案,多年来研发者一直在不断尝试。因此在这次埃博拉病毒爆发后,拥有较多的积累数据,并且有很多经过验证的治疗选择。默克公司和Newlink公司开发的减毒活疫苗是西方开发的唯一一种已完成Ⅲ期临床试验的埃博拉疫苗,并且正在世界卫生组织(WHO)的扩大使用条约的范围内进行给药。(虽然中国和俄罗斯都有相关疫苗获得批准,但均未被刚果民主共和国采用。)
默克公司的疫苗行动迅速。在几内亚和塞拉利昂进行的埃博拉病毒研究显示,默克公司疫苗(水疱性病毒扎伊尔埃博拉病毒重组体(rVSV-ZEBOV))注射一次后,效果达到100%,这次研究招募了5837人。在随机立即接种疫苗的受试者中没有发生感染病例(疫苗接种后10天或更长时间发病),而在未接受疫苗接种的对照组中发生了23例埃博拉病毒感染。
由于具备复制能力,VSV [载体]的表现优于其他疫苗。单次注射的疫苗免疫方案,是一种在病毒急性爆发期间特别有用的方案。它对保护性免疫的快速诱导可能是由于先天免疫系统的激活,但疫苗的持续时间尚不完全清楚。
该疫苗是由加拿大国家微生物实验室开发的,于2014年底授权给Newlink Genetics公司,后者与默克公司签订了开发协议。运往刚果民主共和国(DRC)的疫苗供应来自30万剂量的库存,默克于2016年与促进低收入国家疫苗分销的多边国际组织——日内瓦疫苗联盟Gavi创建了提前购买协议。默克研究实验室疫苗临床研究主任介绍说,公司一直在维持库存,并继续酌情补充库存。这些产品来自默克公司在宾夕法尼亚州临床试验规模的生产。位于德国商业规模的生产设施仍在进行审核,这延迟了疫苗的监管备案。
在治疗方面,MappBio公司的ZMapp领先。在非人类灵长类动物模型的临床前工作方面,ZMapp胜过其他治疗方法。ZMapp是一种鸡尾酒疗法,其3种抗体结合在埃博拉病毒糖蛋白GP上的不同表位,GP在天然状态下以三聚体形式存在并且介导对细胞的附着和感染。ZMapp鸡尾酒治疗已经在几种非人类灵长类动物模型和不同的BSL-4设施中进行了测试,并且是唯一具有临床有效性数据的药物。在西非爆发期间进行的一项二期临床研究表明,在36名接受ZMapp药物和标准治疗药物的患者中有8例死亡,而35例只接受标准治疗的患者中有13例死亡。但随着疫情逐渐减轻,该试验没有达到100名患者的目标入组率,结果并不具有统计学意义。此外,研究者指出,ZMapp可能因施用得太晚而不能使那些死亡的患者受益,死亡的8个患者中,其中7个患者仅接受三个计划剂量中的一个,而第8个患者接受了两个剂量。低风险患者的存活率为100%。
即使ZMapp及时给药,其三剂量方案也存在问题。MappBio公司目前在烟草植物叶片中生产药物的过程是一个问题。研究者介绍说,他们遇到的问题是还没有人提交过使用烟草生产药物的申请。出于这个原因,该公司正在转向使用传统的中国仓鼠卵巢表达系统。MappBio公司的目标是根据美国食品和药物管理局的动物试验规则(对于通常不能在人体中进行测试的产品),到2022年获得批准。与此同时,MappBio公司正在研究下一代药物,并提供更方便的剂量时间表,这是广大埃博拉药物开发者共同的目标,因为重复给药对有限的医疗资源造成压力。例如,Gilead制药公司正在开发的一种小分子抗病毒药物Remileivir(GS-5734),需要超过12天每天静脉输注。
新一代单剂量药物中的第一个产品是Regeneron制药公司的三抗体鸡尾酒REGN-EB3。Regeneron公司战略项目方向副总裁介绍说其产品只需一剂就能有效。REGN-EB3最初被设计为三次注射产品,但非人类灵长类动物实验证明在两次剂量后即可具有保护作用。该公司随后发现,较高的前端剂量提供了类似的保护,即使在症状动物中也是如此。美国国家过敏和传染病研究所疫苗研究中心和合作伙伴正在开展另一个单次治疗药物。Mab114是一种单抗体药物,通过筛选刚果民主共和国(DRC)从1995年以来爆发埃博拉病毒感染幸存者的B细胞库获取。Mab114在试验猕猴遭遇埃博拉病毒攻击五天后给予保护。然而,由于缺乏临床数据,Mab114目前在WHO优先列表中位置较低。富士公司旗下的富山化学公司也开发了疫苗favipiravir。根据世卫组织自己的评估,其疗效尚不确定,尚未确定适当的剂量。
对于治疗埃博拉病毒的药物,人体临床试验只能评估药物的安全性、耐受性和药代动力学特征。为了评估疗效,药物开发者必须进行非人类灵长类动物感染研究,这需要获得数量有限的BSL-4设施,这是药物开发者的主要瓶颈。研究者指出数据非常难以获得,因为进行这些研究非常困难。
抗埃博拉药物缺乏商业可行性是发展的另一个主要障碍。许多项目在重大疫情开始减弱时,建立并积攒了足够的势头继续到现在,但其他一些项目被淘汰。加拿大的Arbutus 生物公司搁置了一种有前景的脂质纳米粒子短干扰RNA药物TKM-130803研究。尽管Novavax公司研发总裁描述了有前景的数据和明确的许可途径,但由于没有市场,Novavax公司仍停止了一种针对埃博拉GP三聚体的脂质纳米颗粒佐剂重组疫苗。2017年9月,美国生物医学高级研究与发展管理局(BARDA)指定了四个项目获得发展资金和库存采购计划,来自强生公司和默克公司的疫苗项目分别获得了4470万美元和3920万美元,MappBio公司的ZMapp和Regeneron公司的REGN-EB3项目,分别获得了4590万美元和4040万美元。
关于疫情爆发后配置的资源是否足够,仍然是一个悬而未决的问题。西非疫情导致28,616人发病,11,310例死亡,其规模和持续时间前所未有。刚果民主共和国在1976年至2017年期间爆发的八次埃博拉疫情中,每次爆发的病例都不到400人(有些远远少于400例),并在六个月内得到解决。这些较小的爆发可能提供更好的基准,以衡量默克疫苗在限制当前疫情方面的有效性。希望通过增加有效的疫苗和药物来加强卫生当局的能力以及未来解决其他疫情的能力,但应对措施的管理始终至关重要。本次疫情与2014年疫情相比,响应措施完全不同。目前的相应可为未来的突破提供蓝图。
(编译作者:王欣伊)