根据药智数据库最新统计,2018年4月份CDE共承办新的药品注册申请以受理号计有453个(复审除外,下同)(图1)。
本月受理总量出现回落,相比3月减少50.6%,其中化药345个,中药25个,生物制品76个,药用包材2个,药用辅料3个,原料药1个。以下分析一下化药、中药、生物制品的注册受理及审评情况。
一、化药审评情况
2018年4月份CDE共承办新的化药注册申请以受理号计有345个(图2)。

从化药的申报来看,本月除新药增加一个受理号外,补充申请、进口、进口再注册、仿制均有不同程度的减少。
1.化药1类新药申报情况。
本月CDE受理化药1类新药共计29个受理号,涉及10个品种11家企业。下图为4月新承办1类新药(表一)。
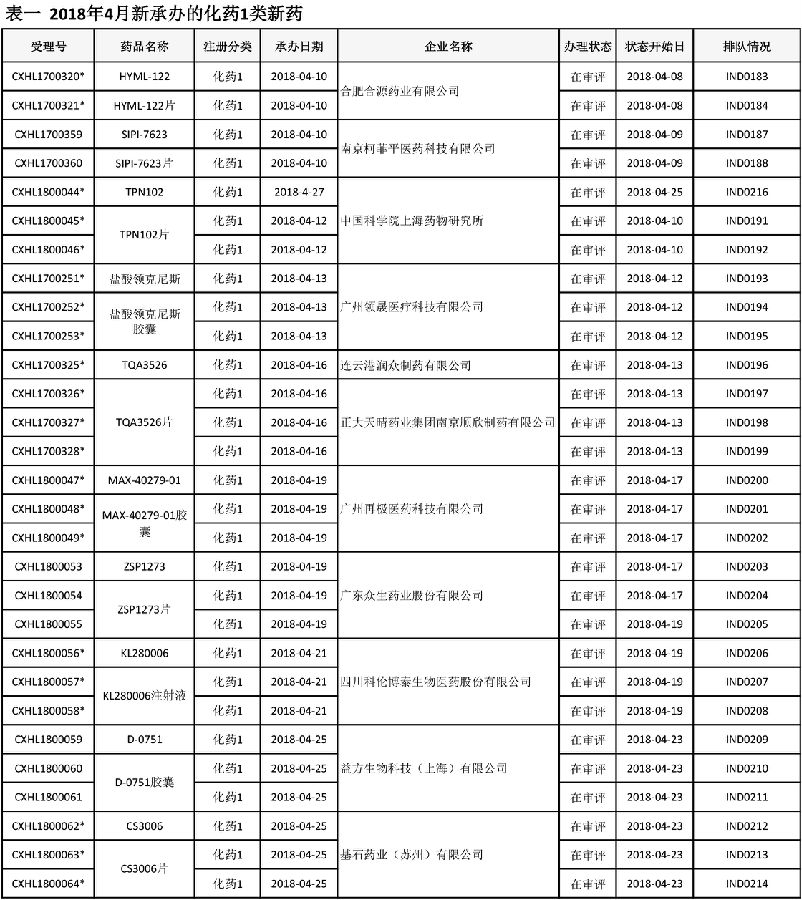
中国科学院上海药物研究所研发的TPN102及片剂,为新型抗癫痫候选药物。体内药效学实验表明,TPN102在小鼠最大电休克急性癫痫模型、小鼠化学诱导急性癫痫模型和大鼠慢性电点燃癫痫模型中均表现出明显的治疗作用,且效果优于一线抗癫痫药托吡酯,并且在托吡酯无效的难治性癫痫动物模型中,表现出良好的治疗效果。TPN102代谢性质稳定,生物利用度高(~100%),具有良好的血脑透过率,对主要CYP450酶无诱导及抑制作用,药代动力学性质良好。TPN102无hERG抑制作用,无肝肾细胞毒性,无遗传毒性,主要毒性表现为扩大的药理学作用,表现出良好的安全性。于2017年12月向CFDA递交临床试验申请,目前已获得药审中心承办,排队待审。
正大天晴药业集团本月申请第二项化药创新药—TQA3526(图3)。

广州再极医药科技有限公司申报的1类创新药—MAX-40279-01目前已进入药审中心。该产品由再极医药科研人员自主研发,用于治疗急髓性白血病(AML)。临床前研究数据显示,Max-40279通过对FLT3和FGFR的双重强烈抑制和较高的骨髓血药浓度,有效克服当前临床应用药物的骨髓FGF通路激活的耐药性,是国际领先临床试验产品。根据公司发布的信息其临床产品Max-40279已正式获得美国食品和药物管理局(FDA)颁发的孤儿药资质。
ZSP1273及片剂是由广东众生药业股份有限公司和上海药明康德新药开发有限公司共同研发的具有明确作用机制和自主知识产权的流感病毒RNA聚合酶抑制剂。临床前研究结果表明,ZSP1273具有很强的体外广谱抗甲型流感病毒活性,对多种甲型流感病毒的抑制能力明显优于同靶点化合物以及神经氨酸酶抑制剂奥司他韦;体内药效试验也较同靶点参考化合物和奥司他韦有更佳的保护动物、降低动物肺部病毒滴度的药效;临床前研究结果表明,ZSP1273对于奥司他韦耐药的病毒株及高致病性禽流感具有强抑制作用。试验结果亦显示ZSP1273和奥司他韦联合用药展现强协同作用,可以增强临床抗流感病毒效果。上述结果预示ZSP1273在临床上具有非常重大的临床应用价值。(来源其上市公告)ZSP1273及片剂是由广东众生药业股份有限公司2018年申报的第二项1类化药创新药。
四川科伦博泰生物医药股份有限公司4月新申报一项创新KL280006及注射液。术后疼痛为临床最常见的急性疼痛,阿片类药物被权威指南推荐为术后镇痛,尤其是多模式镇痛重要的组成部分。目前临床常用的阿片类药物主要为中枢性镇痛药,该类药物存在呼吸抑制、烦躁不安、成瘾性、瘙痒和便秘等诸多不良反应。KL280006注射液是科伦博泰研发的具有自主知识产权的选择性外周κ阿片受体激动剂,实现有效镇痛的同时,能避免中枢镇痛类药物的不良反应,拟用于急性疼痛(如术后疼痛)的治疗。非临床研究数据证实KL280006注射液作用机制明确,对外周κ受体具有高亲和性和高选择性,不易透过血脑屏障,镇痛效果确切兼具良好的安全性和耐受性,无心脏、呼吸及中枢神经系统等不良反应。目前,全球尚无外周选择性κ受体激动剂类获批上市。(来源其上市公告)
2.化药1类进口药申报情况。
本月1项进口化药1类药获得承办(表二)。

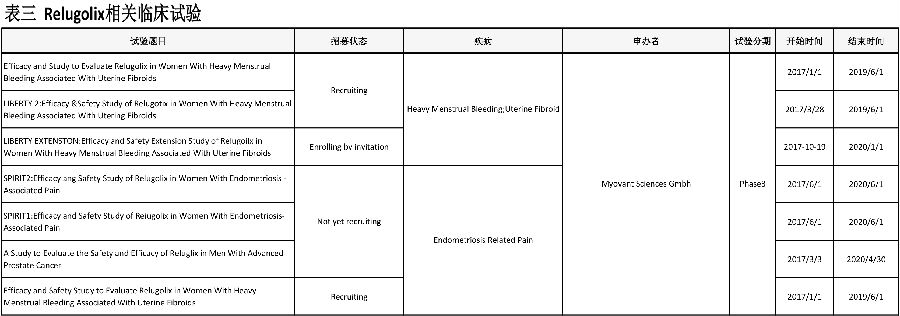
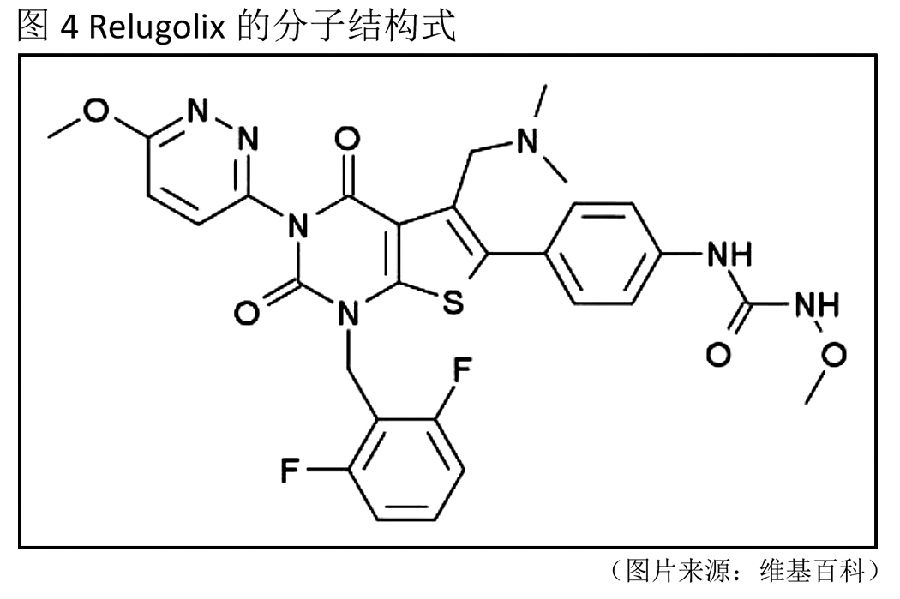
Relugolix是一种每日一次口服的小分子促性腺激素释放素(GnRH)受体拮抗剂,由Myovant公司与武田(Takeda)共同开发。此次申请是武田药品(Takeda)首次在国内申报进口(图4)(表三)。
二、中药审评情况
4月份CDE承办新的中药注册申请受理号共计25个,其中新药2个,补充申请23个(图5)。

山东省药学科学院提交了两项中药5类新药的上市申请,分别为侧金盏口腔溃疡贴片和黄蜀葵花总黄酮提取物。
三、生物制品审评情况
4月份CDE承办新的生物制品注册申请受理号共计76个,新药32个,补充申请37个,进口7个(图6)。

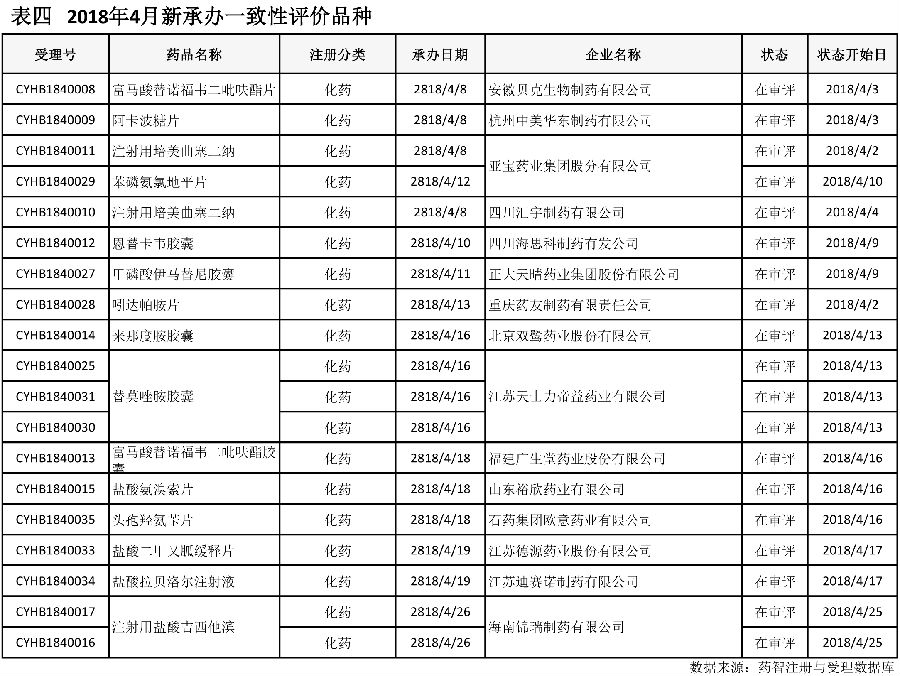
四、按一致性评价申报的品种情况
本月共计15个品种按一致性评价要求进行申报。本月新增三项注射剂的一致性评价品种(表四)。
(来源《药智网》)