本文将分析2017年新药(NTD)的审批情况,NTDs新药被定义为由FDA药物评估和研究中心(CDER)和生物制品评估与研究中心(CBER)批准的新分子实体,组合产品至少增加一个新的分子实体作为活性成分,但是诊断成像剂不包括在内。本文将针对这些NTD的峰值年销售额进行比较。
2017年,美国食品和药物管理局批准了52个新药,预计年销售额达到470亿美元,远高于2016年的320亿美元,略高于400亿美元的长期均值(图1)。尽管如此,2017年与2016年相比,每个批准产品的平均预测销售额较低;2017年的平均销售额从2016年的11亿美元下滑至9亿美元,低于2008-2009年的数据。销售额中值也从2016年的7亿美元下降至2017年的5亿美元。
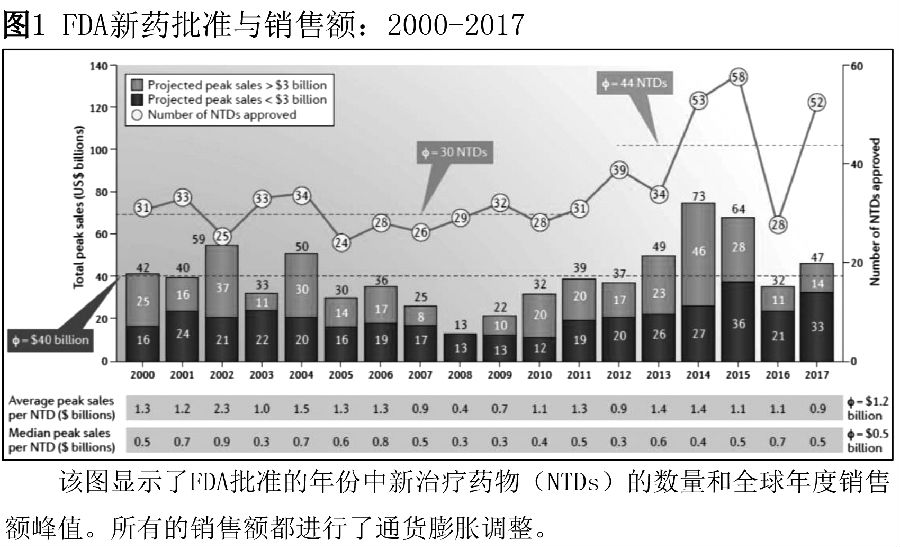
3个批准的NTD-赛诺菲公司/Regeneron公司的dupilumab,罗氏公司的ocrelizumab和诺和诺德公司的semaglutide,预计年销售额达到30亿美元,与2016年相当。然而,在中档范围内,批准的NTD的销售额下降。尽管单1年并未有明显的趋势,但分析有两个原因:适应症和/或治疗机制(如PD1或PDL1抑制剂)的竞争导致市场份额下降和价格压力;而且许多NTD适应症针对的患者数量较少(例如,针对特定的基因型)。
肿瘤学领域的新药仍然是主要的价值驱动因素,占2017年总销售额的32%,将维持其长期(自2010年以来)以来约1/3的平均贡献率。除肿瘤药物外,其他药物的贡献每年都有所不同,2017年,中枢神经系统NTD排名第二。
突破性治疗指定新药(BTD)的批准也有所增加,2017年共有20种此类产品(占NTD批准的38%)获得批准通过,较2016年增加7个BTD(25%)。此外,这些BTD预计将产生65%(> 300亿美元)的新药销售额,高于2016年的45%。
自2012年以来,每年批准的NTD的平均数量已超过40个,而2000-2011年的平均数量为30个(图1)。目前审批数量的持续性增加,除了FDA在早期提升审批效率的努力之外,还包括对于审评工具等评审工作的改进,更好的内部决策以及持续关注缺乏有效治疗药物的适应症。其中也有风险可能会减少审批数量,例如创新如何得到回报。尽管如此,短期内研究者认为这些风险会有所减弱,研究者谨慎乐观地认为,2018年的药品销售额将达到甚至超过2017年的高位。预计每种药物的平均销售额将保持接近2017年的水平,因为研发管线中有很多特殊药物,并且在一些适应症和用药机制中竞争日益激烈。
(编译作者:王欣伊)