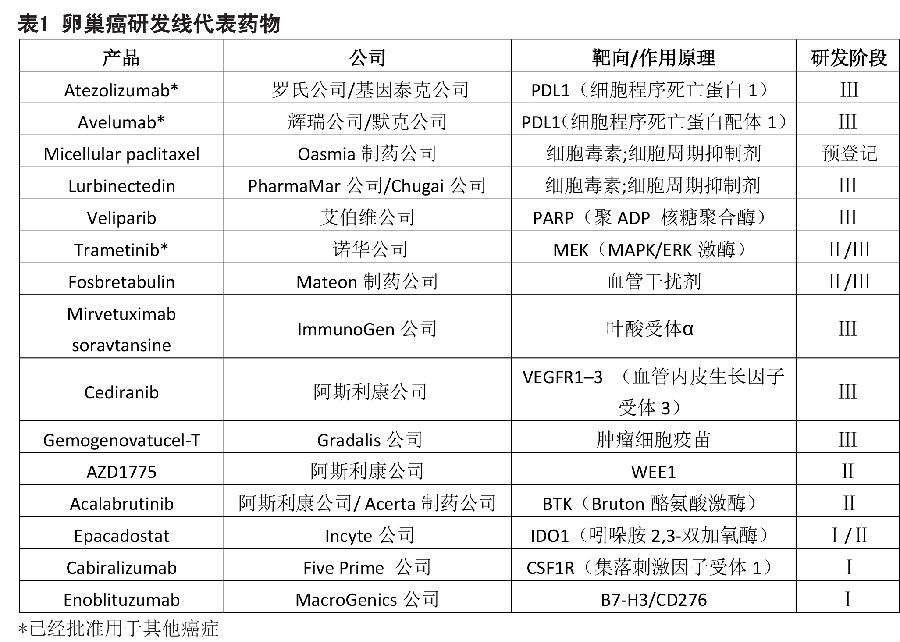
2016年,美国约有两万名患者被诊断患有卵巢癌。大多数(90%)的卵巢恶性肿瘤起源于上皮细胞,通过组织学特征可分为浆液性,粘液性,子宫内膜样或透明细胞卵巢癌。高分化浆液性肿瘤根据是否存在编码乳腺癌Ⅰ型和Ⅱ型易感性蛋白(BRCA1和BRCA2)的基因突变进行细分,这类突变存在于10-15%的卵巢癌中。超过60%的卵巢癌患者被诊断为晚期(Ⅲ-Ⅳ期)疾病,其主要治疗方法是铂类化疗。血管内皮生长因子(VEGF)抑制剂贝伐珠单抗(Avastin;罗氏公司/Genentech公司)被批准(不包括美国)作为一线治疗药物与标准化疗药物联合使用。在欧洲和美国,贝伐珠单抗也被批准用于复发性卵巢癌。
PARP抑制剂
聚ADP核糖聚合酶(PARP)抑制剂正在改变卵巢癌治疗领域。Olaparib(Lynparza;阿斯利康公司)是第一个进入卵巢癌市场的PARP抑制剂,FDA基于Ⅱ期研发数据,在2014年批准olaparib进入加速审批流程,用于治疗三线及以上化疗后的生殖细胞系BRCA突变(gBRCAm)型晚期卵巢癌。一项潜在的验证性Ⅲ期试验SOLO-3正对olaparib用于该适应症进行测试。在欧洲,2014年olaparib被有条件地批准用于复发生殖细胞系和/或体细胞BRCA突变(g/sBRCAm)高级别浆液性卵巢癌的维持治疗。根据批准的要求,在SOLO2的Ⅲ期试验中,比较了olaparib与安慰剂维持治疗复发性铂敏感性gBRCAm卵巢癌的无进展生存期,olaparib效果优于安慰剂(olaparib 30.2个月VS安慰剂5.5个月)。2017年3月,基于SOLO-2的试验结果,FDA授予olaparib作为维持治疗药物的优先审查权;PDUFA确定的上市日期是在2017年第三季度。第三个正在进行的Ⅲ期试验(SOLO 1)数据,可用于寻求批准olaparib作为一线维持药物在BRCAm癌患者中使用的依据。
第二个上市的PARP抑制剂是rucaparib(Rubraca; Clovis肿瘤药公司),该药于2016年12月获得FDA的加速批准,比其PDUFA日期提前2个月。rucaparib的适应症是经过二线及以上化疗的g/sBRCAm晚期卵巢癌。加速批准是基于两个单臂Ⅱ期试验的客观反应率(ORR; 54%)和中位反应持续时间(9.2个月)(Study 10研究和ARIEL 2研究)。后续的审批将取决于确认研究;一项Ⅲ期研究ARIEL-4,正在与ARIEL 2相同的人群中评估rucaparib。在ARIEL-3研究中,正在评估将rucaparib作为维持药物,治疗与同源重组DNA修复缺陷(HRD)相关的铂敏感复发性高级别卵巢癌和子宫内膜卵巢癌。
2017年3月,niraparib(Zejula; Tesaro)成为第3个获得FDA批准的PARP抑制剂,比其PDUFA日期提前3个月。Niraparib是第一个经FDA批准的用于铂敏感性复发性卵巢癌维持治疗的PARP抑制剂,与olaparib优选审查的适应症相同。与olaparib和rucaparib不同,niraparib无论BRCAm类型还是HRD类型的适应症都获得批准。在Ⅲ期NOVA试验中,niraparib相对于安慰剂改善了对gBRCAm(21个月VS安慰剂5.5个月)和非gBRCAm(9.3个月VS安慰剂3.9个月)卵巢癌患者的无进展生存期,并最终由于该试验结果获得批准上市。两项试验旨在扩大niraparib的适应症范围,其中PRIMA试验评估niraparib作为一线维持药物的疗效,另一个QUADRA试验评估niraparib在第四期和更晚期的癌症复发环境中的效果,BRCA突变或HRD不是先决条件。
产品线
PARP抑制剂正在改变卵巢癌的治疗并提高疗效。其他在研生物和小分子药物也有望扩大治疗范围。
目前产品线中最有前途的药物以程序性细胞死亡蛋白1配体1(PDL1)为靶向。avelumab(由辉瑞/默克KGaA开发)的2个Ⅲ期试验和atezolizumab(由罗氏制药/基因泰克公司开发)的3个Ⅲ期试验正在进行。对于新诊断的晚期疾病,JAVELIN Ovarian 100试验正在评估avelumab在化疗后或与化疗中的维持治疗是否优于单独化疗,而IMagyn050试验将确定将atezolizumab加入化疗以及与贝伐单抗联合用药的益处。
对于铂耐药性复发性疾病,正在评估atezolizumab与聚乙二醇化脂质体多柔比星(PLD)(Caelyx;杨森公司)加或不加贝伐珠单抗联合用药,与PLD联合贝伐珠单抗相比的疗效。在同样的患者群体中,JAVELIN Ovarian 200试验正在评估avelumab作为单一药物,以及与PLD联合使用,相对PLD单独使用的疗效。ATALANTE试验(仅法国)在评估atezolizumab与化疗药物和贝伐珠单抗联合用药在铂敏感性复发性疾病中的疗效。
紫杉醇是常用于卵巢癌的细胞毒剂类药物。紫杉醇(由Oasmia制药公司开发)的新剂型可以减轻与常规紫杉醇相关的副作用,目前紫杉新剂型正在欧洲进行审评,在美国预计2017年申请审批。另一种细胞毒剂(由PharmaMar/Chugai公司研发)在Ⅲ期CORAIL试验中评估与PLD或拓扑替康相比的疗效。
3个已上市的PARP抑制剂为艾伯维公司的新药veliparib铺平了道路。与olaparib,rucaparib和niraparib批准时的临床试验不同,veliparib的Ⅲ期试验评估veliparib在同时进行铂类化疗的患者,以及以前未治疗的晚期浆液性肿瘤中的维持作用。诺华公司的trametinib是一种MAPK/ERK激酶(MEK)抑制剂,在Ⅱ期/Ⅲ期研究中,评估trametinib对于复发性或进行性低级别浆液性卵巢癌的疗效;另一种MEK抑制剂即Array生物制药公司的binimetinib,Ⅲ期试验进行了相同的设计,但在2016年中断。
之前用于治疗铂抗性复发性肿瘤,目前处于Ⅲ期试验的药物包括:fosbretabulin(Mateon制药公司研发),一种可与微管蛋白结合的血管破坏剂;以及ImmunoGen公司研发的mirvetuximab soravtansine,这是一种以叶酸受体α(在高于90%的非粘液性卵巢癌被过度表达)为靶向的抗体-药物共轭体。Fosbretabulin和mirvetuximab soravtansine联合其他药物的早期试验正在铂敏感性肿瘤患者中进行。
阿斯利康公司的cediranib,是一种口服的血管生成抑制剂,正在与奥拉帕尼联合用于铂敏感和铂抗药性复发性疾病。在2016年,阿斯利康公司撤回了在欧洲市场cediranib与化疗药物联合后用cediranib进行维持的上市许可申请。另一个正在进行的Ⅲ期试验正在测试自体肿瘤细胞疫苗gemogenovatucel-T(由Gradalis公司开发),作为高级浆液性晚期疾病的维持治疗效果。
处于早期研发阶段的新药物靶向包括WEE1,Bruton酪氨酸激酶,吲哚胺2,3双加氧酶,集落刺激因子受体1和B7-H3/CD276。在Ⅰ/Ⅱ期卵巢癌临床试验中,主要评估这些靶向的抑制剂与PDL1抑制剂联合使用,在复发性疾病中的效果。
市场预测
连续的PARP抑制剂(olaparib,rucaparib和niraparib)获得批准使用以及预期将要上市的两种PDL1抑制剂(avelumab和atezolizumab)将推动市场的巨大增长,预计2026年将达到67亿美元(图1)。预计PARP抑制剂将成为销售领先的药物类别,由于其卓越的疗效、较长的治疗期和较大的患者人群及一线治疗药物的地位,PARP抑制剂2026年的销售额将达35亿美元(占总销售额的50%)。
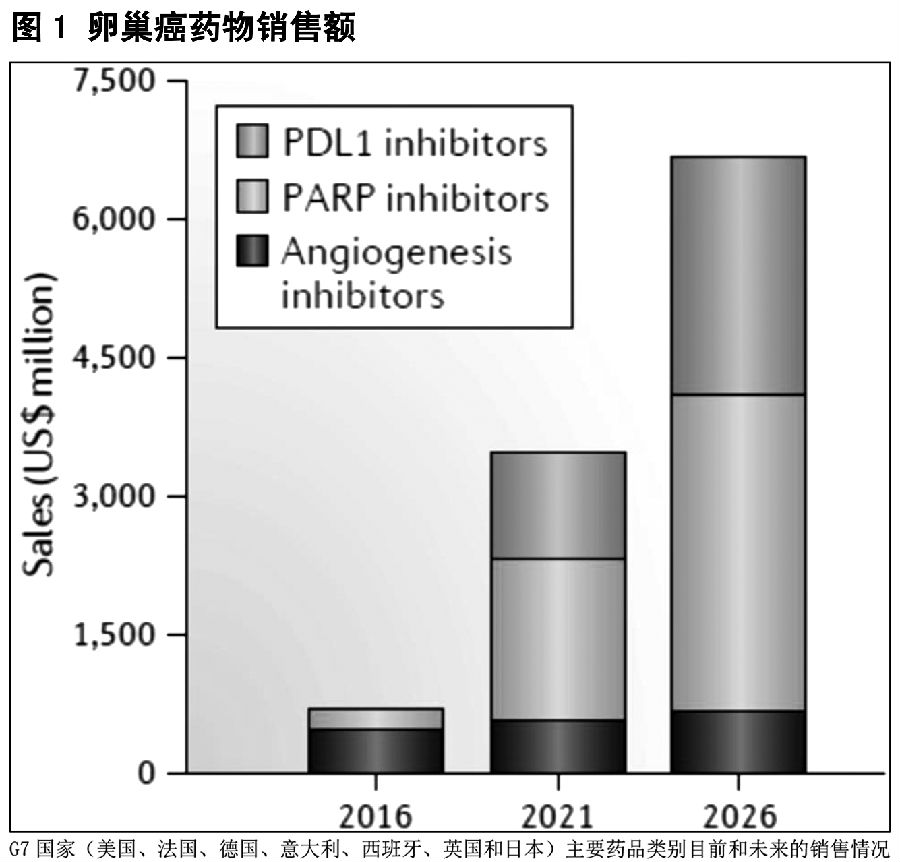
由于其广泛的适应症标签,预计niraparib将对卵巢癌市场影响最大,2026年niraparib销售额将约占PARP抑制剂销售额的2/3。与olaparib单一适应症gBRCAm相比,rucaparib的早期治疗定位和更广泛的适应症标签(包含g/sBRCAm)预计将冲击olaparib率先进入市场的优势。在没有BRCA突变或HRD的患者中批准使用niraparib,可给予niraparib战胜olaparib和rucaparib的竞争优势;如果没有改变,olaparib和rucaparib较窄的适应症标签将限制其销售潜力。
预期PDL1抑制剂销售额在2026年将达到26亿美元。首个进入卵巢癌市场的PDL1抑制剂Avelumab,由于其作为维持治疗药物的大量使用以及较长的使用期,预计将在2026年成为该类别销售额贡献(75%)最大的药物。尽管PDL1抑制剂有较好的市场前景,但在拥挤且竞争激烈的市场中,抢占市场份额仍具有挑战性。
尽管血管生成抑制剂在2016年占据市场份额的大部分,但该药物类别预计在2026年市场份额将减少。贝伐珠单抗的持续用药,特别是在铂敏感型复发性疾病患者中的扩大使用,将推动其销售增长;然而,更便宜的贝伐单抗生物仿制药的进入,以及来自PARP和PDL1抑制剂的强烈竞争可能阻碍销售的增长。