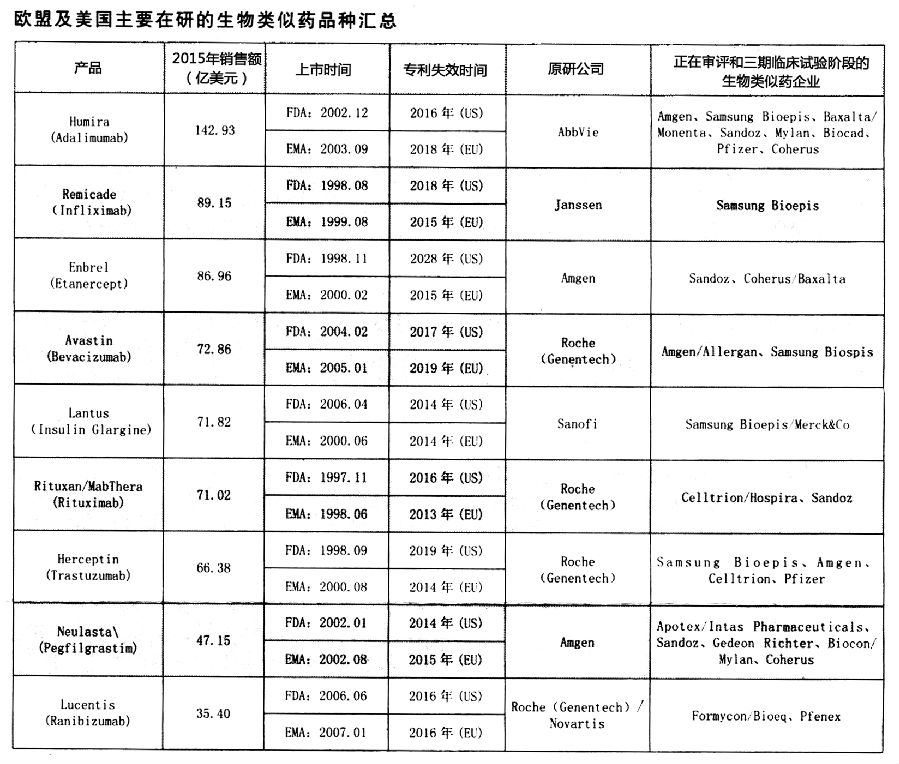
生物药当前发展日新月异,2015年全球销售额排名前10的药品中生物药雄踞8席,其中单克隆抗体药物占6席,甘精胰岛素和肺炎球菌疫苗Prevnar 13各占1席。预计2020年,全球生物制药的市场规模接近4000亿美元,在全球药品市场总价值中所占的比例将接近30%。随着“重磅炸弹”生物药在欧盟及美国的专利逐渐到期,受生物类似药蕴藏的巨大市场潜力吸引,越来越多的公司加入到这些“重磅炸弹”产品生物类似药的开发竞争之中。目前,对于生物类似药的开发集中在9个专利即将到期的重磅品种上,尤其是全球销售前10位的单抗药物。本文对9个“重磅炸弹”产品的生物类似药的开发进行统计,主要对其在欧盟药品管理局(EMA)及美国食品药品管理局(FDA)处于审评中和推进到Ⅲ期临床阶段的仿制情汇总分析。
阿达木单抗
阿达木单抗( Adalimumab)是一种抗肿瘤坏死因子a(TNFa)的全人源单克隆抗体药物,由Abbvie公司研发,分别于2002年12月和2003年9月获得FDA和EMA批准上市。阿达木单抗能与TNFa结合,并中和TNFa的生理活性而发挥抗炎作用。其适应证为:轻至重度风湿性关节炎、银屑病关节炎、强直性脊柱炎、轻至重度克罗恩氏病、轻至重度斑块状银屑病、幼年特发性关节炎、轻至重度溃疡性结肠炎、中轴性脊柱关节炎、重度儿童克罗恩氏病、反常性痤疮和幼年附着点炎相关性关节炎。该药自2012年登上“全球最畅销药品”榜首以来,已连续4年蝉联冠军,2015年全球销售额高达143亿美元。
目前,多家药企正在进行阿达木单抗的生物类似药的开发,冲在最前的公司当属Amgen公司,已于2015年11月和12月分别向EMA和FDA递交Amjevita (Adalimumab-atto,ABP501)的上市申请并获受理。今年9月,FDA批准了ABP501的上市申请,这也是FDA批准的第4个生物类似药。今年7月,Samsung Bioepis公司向EMA递交了SB5的上市申请并获受理。Baxalta公司和Momenta公司合作开发的M923正在进行Ⅲ期临床试验,紧跟其后的是Sandoz公司开发的GP2017、Mylan公司开发的MYL-1401A、Biocad公司开发的BCD-057、Pfizer公司开发的PF -06410293和Coherus公司开发的CHS -1420。
英夫利昔单抗
英夫利昔单抗(Inflixamab)是一种抗肿瘤坏死因子a(TNFa)的人鼠嵌合型单克隆抗体药物,由Janssen公司研发,分别于1998年8月和1999年8月获得FDA和EMA批准上市。该药通过与TNFa结合,中和TNFa的生理活性而发挥抗炎作用。其适应证为:克罗恩氏病、溃疡性结肠炎、风湿性关节炎、强直性脊柱炎、银屑病关节炎、斑块状银屑病。2015年,该药的全球销售额高达89亿美元,位列生物药销售额的第2位。
截至目前,共有3个英夫利昔单抗生物类似药获得EMA批准上市,分别为Hospira公司的Inflectra、Celltrion公司的Remsima和SamsungBioepis公司的Flixabi。今年5月.SamsungBioepis公司向FDA提交了SB2的上市申请并获受理。
依那西普
依那西普( Etanercept)是重组人TNF受体和人IgG -Fc的融合蛋白药物,由Amgen公司研发,分别于1998年11月和2000年2月获FDA和EMA批准上市。该药通过中和TNFa的体内活性而发挥抗炎作用。其适应证为:类风湿性关节炎、幼年类风湿关节炎、银屑病关节炎、斑块状银屑病和强制性脊柱炎。2015年,该药的全球销售额达87亿美元,位居生物药销售额的第3位。
在依那西普的生物类似药开发方面.今年1月,Samsung Bioepis公司开发的Benepali已获EMA批准上市。Sandoz公司于2015年10月向FDA递交了GP2015的上市申请并获受理,Co-herus公司和Baxalta公司合作开发的CHS-0214处于Ⅲ期临床试验阶段。
贝伐珠单抗
贝伐珠单抗( Bevacizumab)是一种抗血管内皮生长因子(VEGF)的人源化单克隆抗体药物,由Roche公司旗下的Genentech公司研发,分别于2004年2月和2005年1月获得FDA和EMA批准。该药通过抑制VEGF与其位于内皮细胞上的受体相结合,使VEGF失去生物活性而减少肿瘤的血管形成,从而抑制肿瘤的生长。其适应证为:转移性结直肠癌、非小细胞肺癌、大肠癌、宫颈癌、转移性肾癌、卵巢癌和脑癌。2015年,该药的全球销售额达72亿美元。
Amgen公司和Allergan公司合作开发的贝伐珠单抗的生物类似药ABP215已完成Ⅲ期临床试验,Samsung Bioepis公司开发的SB8正在进行Ⅲ期临床试验。
甘精胰岛素
甘精胰岛素(Insulin Glargine)是一种重组人欧盟及美国主要在研的生物类似药品种汇总胰岛素类似物药物,由Sanofi公司研发,也是首个长效胰岛素药物,分别于2000年6月和2006年4月获EMA和FDA批准上市,适应证为需要胰岛素治疗的Ⅰ型和Ⅱ型糖尿病。甘精胰岛素通过与细胞表面胰岛素受体结合,从而发挥调节糖代谢作用。它为酸性溶液,呈完全溶解状态,在中性pH条件下溶解度较低,注入皮下组织后形成微细沉积物,可以持续释放,从而发挥长效降血糖作用。2015年,该药的全球销售额接近72亿美元。
2014年9月,EMA批准了Eli Lilly公司的甘精胰岛素生物类似药Abasaglar上市,这也是EMA批准的首个胰岛素类生物类似药。2015年12月,FDA批准了Eli Lilly公司的甘精胰岛素生物类似药Basaglar上市,该品种通过505 (b) (2)监管途径提交申请。
2015年12月,Samsung Bioepis公司和Merck&Co公司向EMA提交了甘精胰岛素生物类似药MK-1293的上市申请并获受理;今年8月,Samsung Bioepis公司和Merck&Co公司向FDA通过505(b)(2)途径以follow-on biologics形式提交了MK-1293的上市申请并获受理。
利妥昔单抗
利妥昔单抗(Rituximab)为一种抗CD20的人鼠嵌合性单克隆抗体药物,由Roche公司旗下的Genentech公司研发,分别于1997年11月和1998年6月获得美国食品药品管理局(FDA)和欧盟药品管理局(EMA)的批准。该抗体与B淋巴细胞表面CD20抗原特异性结合,通过补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC)机制而引起B细胞溶解。其适应证为:非霍奇金淋巴瘤、慢性淋巴细胞白血病、类风湿性关节炎。2015年,该药的全球销售额达71亿美元。
利妥昔单抗在研的生物类似药情况是,Celltrion公司和Hospira公司合作于2015年11月向EMA提交了CT-P10的上市申请并获受理;今年5月,Sandoz公司向EMA提交了GP2013的上市申请并获受理。
曲妥珠单抗
曲妥珠单抗(Trastuzumab)是抗人表皮生长因子受体2(Her2)的人源化单克隆抗体药物,由Roche公司旗下的Genentech公司研发,分别于1998年9月和2000年8月获得FDA和EMA批准。该药通过与癌细胞表面过表达的Her2结合,阻止人体表皮生长因子在Her2上的附着,从而阻断癌细胞的生长。另外,通过抗体依赖的细胞介导的细胞毒效应杀伤癌细胞。该药用于乳腺癌的辅助治疗、转移乳腺癌的治疗、转移胃癌或胃食管连接部腺癌的治疗,2015年其全球销售额达66亿美元。
在曲妥珠单抗的生物类似药研发方面,Samsung Bioepis公司开发的SB3、Amgen公司开发的ABP980和Celltrion公司开发的CT-P06都处于Ⅲ期临床试验阶段;紧跟其后的是Pfizer公司开发的PF-05280014,处于早期临床研究阶段。
培非格司亭
培非格司亭(Pegfilgrastim)是聚乙二醇(PEG)化修饰的重组人粒细胞刺激因子药物,由Amgen公司研发,分别于2002年1月和2002年8月获得FDA和EMA批准。该药通过与髓系造血祖细胞及粒细胞表面受体结合,促进髓系造血祖细胞的增殖、分化和成熟,调节中性粒细胞的增殖、分化和成熟,从而提高外周中性粒细胞的数量及活性。由于PEG化修饰能减少肾小球的过滤,使得该药在体内的清除减慢,半衰期大大延长,从而达到长效发挥升高白细胞的目的,其在每个化疗过程中只需注射1次。其适应证为癌症化疗引起的中性粒细胞减少。该药2015年全球销售额达47亿美元。
目前,所有的培非格司亭的生物类似药品种均在审评当中。Apotex公司和Intas Pharmaceuticals公司合作开发的该品种的生物类似药于2014年12月向FDA提交了上市申请并获受理,但迟迟未获批准。Sandoz公司分别于2015年11月和今年2月向FDA与EMA提交了该品种的生物类似药LA-EP2006的上市申请并获受理。但今年7月,诺华公司年报公布的消息显示,其旗下Sandoz公司开发的LA-EP2006遭FDA拒绝批准,并未透漏具体细节。另外,Gedeon Richter公司于2015年12月向EMA提交了该品种的生物类似药的上市申请并获受理。Biocon公司和Mylan公司于今年7月向EMA提交了合作开发的该品种的生物类似药的申请并获受理。Coherus公司开发的该品种的生物类似药CHS-1701处于Ⅲ期临床试验阶段。
兰尼单抗
兰尼单抗(Ranibizumab)是抗血管内皮生长因子(VEGF)单克隆抗体Fab片段药物,由Novartis公司和Roche公司旗下的Genentech公司共同研发,分别于2006年6月和2007年1月获得FDA和EMA的批准。该药的作用机制为,结合VEGF从而减少内皮细胞的增生,阻止血管渗透和新生血管的形成,适用于多种眼科疾病的治疗,包括糖尿病性黄斑水肿、视网膜静脉阻塞继发黄斑水肿、湿性年龄相关性黄斑变性、糖尿病性视网膜病变、病理性近视继发脉络膜新生血管。2015年,该药的销售额达35亿美元。
Formycon公司和Bioeq公司合作开发的兰尼单抗的生物类似药FYB201处于Ⅲ期临床试验阶段;紧跟其后的是Pfenex公司开发的PF582,也进入Ⅲ期临床试验。
点 评
2015年全球生物药的市场规模超过3000亿美元,生物药价格较化学药价格要高很多,这成为其市场份额不断快速上升的因素之一。欧盟和美国作为全球生物制药的“领头羊”,获批的创新生物药数量较多,是全球生物药的主战场。欧盟和美国对生物类似药的支持政策和具体指导原则的出台,推动了生物类似药的发展,也使得欧盟和美国在生物类似药的开发与监管方面起着重要的示范和引领作用。欧盟在生物类似药的开发与审批方面走在世界前列,目前已批准21个生物类似药。美国在生物类似药方面发展较晚,但是随着法规的完善,也已批准了4个生物类似药品种,并且呈现加快趋势。
过去几年,生物类似药产品主要集中在结构相对简单的重组蛋白药物方面,对此,EMA通过生物类似药途径审批,FDA通过505(b)(2)途径审批。近几年来,全球销售额前10位的药物中,生物药占据6~8席,随着这些“重磅炸弹”生物药专利的逐渐到期,为生物类似药的井喷式发展提供了巨大空间,越来越多的公司如Amgen、Samsung Bioepis、Celltrion、Sandoz、Pfizer、Biocon等加入到这些“重磅炸弹”产品的“仿制”中,未来生物类似药的市场竞争也将愈发激烈。
从目前“重磅炸弹”品种的生物类似药研发情况来看,阿达木单抗销售额多年位居全球榜首,对其仿制最为热门,已有众多企业的仿制品种进行到Ⅲ期临床试验及申报上市阶段,而销售额稍低的其他品种研发企业涉及相对较少。这提示,生物类似药研发企业需要关注仿制品种及相关企业的竞争情况,根据企业自我定位,合理选择品种和开发策略。
从EMA和FDA对于培非格司亭生物类似药的审评情况来看,该品种迟迟未获得批准,并且Sandoz公司的培非格司亭生物类似药今年6月遭到FDA的拒绝。2015年,国家食品药品监管总局(CFDA)发布的《生物类似药研发与评价技术指导原则》中也提到,对PEG等修饰的产品及抗体偶联药物类产品按生物类似药研发时应慎重考虑。该品种的“仿制”命运值得关注,同时也提示国外和国内的生物类似药研发企业对于化学修饰类生物类似药的开发要持谨慎态度。
(选自《中国医药报》)