Agios制药公司与合作伙伴Celgene制药公司,正在准备年底申请急性髓系白血病治疗药AG‑221的上市材料。如果获得批准,他们在异柠檬酸脱氢酶2(IDH2)突变抑制剂类别中的第一个产品将实现预期,即靶向药物可通过切断肿瘤特异性的代谢途径杀死癌细胞。
尽管该领域的研究人员对即将获得的批准感到兴奋,但任何成功都来之不易。AG‑221和Agios公司抗异柠檬酸脱氢酶1(IDH1)突变的药物AG‑120,都是抗肿瘤代谢药物产品线中的异类。有专家认为是Agios公司让这两种药物步入正轨。
尽管业内寄希望于基因组分析将提供癌细胞功能获得性代谢突变的相关信息,但至今尚未实现。而常见的代谢途径,即对肿瘤细胞和健康细胞存活均具有重要意义的“普遍途径”,在药物开发方面存在可行性治疗窗和病人分层策略等相关问题。
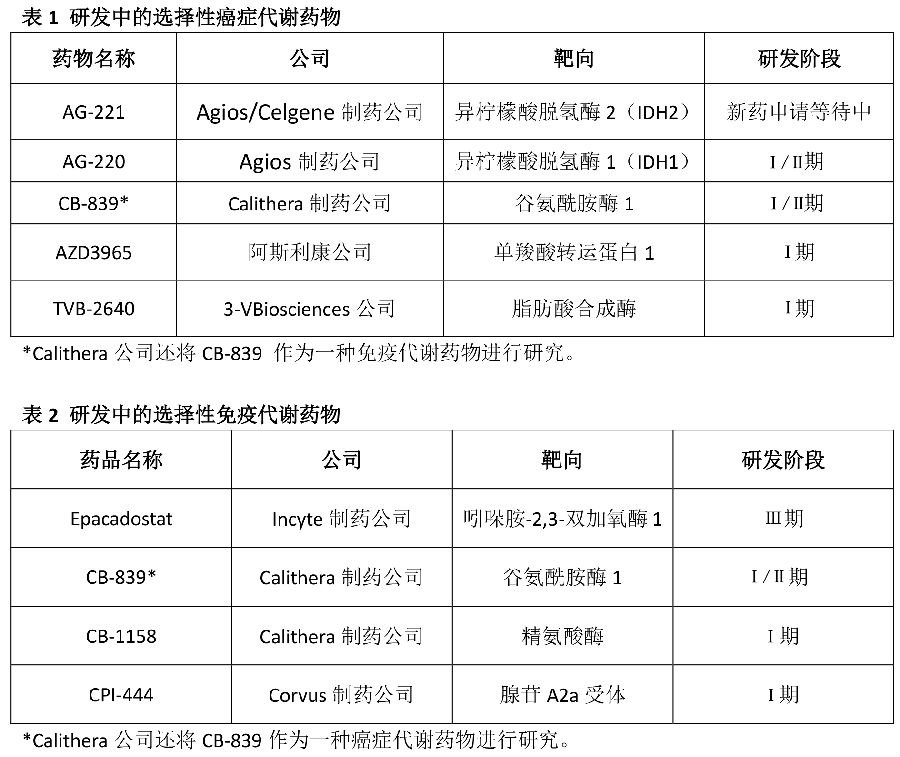
其结果是,只有极少数癌症代谢的候选药物进入临床试验,这些药物大多处于早期研发阶段(表1)。一旦这些药物中的一个进入临床,该药将不能进入Agios公司的IDH抑制剂产品线序列,这样做是在支持并行的项目,该领域生物科技公司的相关负责人介绍说。
然而,新兴的领域也给研究人员提供了新的探索方向。在过去的几年中,癌症代谢的定义已扩大,因为研究人员已经开始看好代谢物在微环境中发挥的免疫抑制作用和免疫激活作用。这些发现促成了免疫代谢药物新作用类别(表2)的产生。在合成杀伤性化合物筛选方面新的兴趣,也为弥补癌症功能获得性代谢突变研究的缺失,提供一种新的手段。
行业的兴趣相对10年前有所下降,正如公司所意识到的,这项工作比他们预期的更加棘手。但该领域目前已趋于稳定,并达到一个健康发展的水平。
令人沮丧的灵活性
大约90年前,德国生物化学家Otto Warburg首先报告,快速增长的癌细胞依靠自我膨胀和不寻常的代谢途径来维持他们的高能源需求。这些发现被遗忘了几十年,直到研究人员在上世纪90年代末为癌症代谢领域重新注入活力。当时,肿瘤学家已经开始应用各种各样针对代谢途径的化疗药物,例如叶酸拮抗剂,可阻断用于DNA和RNA合成与修复的叶酸的生产。第一代抗代谢癌症治疗药具有较高毒性,因为他们破坏的是所有类型细胞的代谢途径。
随着对癌症代谢机制研究的发展,研究人员开始研究确定对癌细胞生存至关重要的途径,甚至唯一途径。他们认为,针对这样的途径,可以提供更加有效和毒性较低的药物。Agios公司的异柠檬酸脱氢酶(IDH)靶向提供了一个很好的案例,促进该领域早期的活跃。
正常代谢中,异柠檬酸脱氢酶(IDH)将异柠檬酸转化为α-酮戊二酸。当在癌症中发生突变后,异柠檬酸脱氢酶还可将α-酮戊二酸转化为2-羟基戊二酸(2HG),高达22%的急性髓细胞性白血病(AML)患者和70%低级别神经胶质瘤患者都会发生这样的突变。Agios公司和其他公司的研究人员已经证明,2-羟基戊二酸(2HG)是一种代谢产物,可调节氧敏感性机制,形成高度甲基化DNA从而导致癌症.
Agios公司成立于2008年,进入这一领域仅仅8年时间,公司与合作伙伴Celgene公司共同进行的临床研究数据不久将支持其产品在FDA的批准。公司提交的用于支持新药批准的Ⅰ/Ⅱ期临床试验数据显示,该药物在复发性或难治性IDH2突变引起的急性髓细胞性白血病(AML)患者中,总有效率可达38%。(如果获得批准,该药将很快就会遭遇到其他的竞争者,包括AbbVie公司首创的开拓性BCL-2靶向药物venetoclax。)
异柠檬酸脱氢酶(IDH)项目的独特之处在于常规代谢酶的突变,然而,目前其他代谢酶之中还没有发现可以利用的功能获得性突变。
尽管这个领域在了解癌细胞的标准代谢途径方面已取得了巨大的进步,但生物体的复杂性阻碍了许多把这些成果转化为药物的努力。癌细胞不仅能够反作用于代谢调节药物,还可以从血清中获取资源补偿任何代谢损失。
以Agios公司针对PKM2做出的早期工作为例。PKM2是一种低活性的丙酮酸激酶剪接变异体,该酶催化糖酵解的最后一步。该酶在大多数癌细胞中被表达,被认为在驱动细胞增殖过程中具有添砖加瓦功能的生物合成作用。Agios公司研发的PKM2刺激剂,将恢复PKM2酶的功能,该药物在体外和体内对细胞增殖有很少或没有影响。在细胞体外培养从介质中移除丝氨酸时,该药物的小分子可杀死癌细胞,这表明丙酮酸激酶的激活使得癌细胞依赖于丝氨酸。问题是,在现实的活体动物中,癌细胞可以从其他途径获取丝氨酸,如从血浆中吸收。研究者需要激活PKM2,然后切断其他代谢途径以获得对体内癌细胞的杀伤作用。
代谢途径的灵活性对于药物的发现者来说是一个巨大的问题。英国癌症研究所(CRUK)的商业分支—癌症研究技术公司(CRT)与阿斯利康公司,于2010年合作研究癌症代谢靶向,研究者重新设计许多基本分析方法和高通量筛选方法,用于药物发现。研究者甚至需要重新思考他们所依赖的高浓度葡萄糖和高浓度谷氨酰胺标准细胞培养技术,因为癌细胞能够从培养基中吸取所需的营养成分。当研究人员将他们的项目推进到动物系统,癌细胞可从血清中获取营养后,项目会变得更加复杂。
由于在体内体外系统的分离,研究者很难将一些靶向推进到临床前试验阶段。
扩充产品线
尽管如此,少数几家公司仍然将几种候选产品推进到临床试验阶段。虽然这些候选药物并非具有像异柠檬酸脱氢酶(IDH)抑制剂这样的肿瘤特异性,但研究者认为常规的代谢途径也可能提供可控的靶向。
Calithera公司的谷氨酰胺酶1(GLS1)抑制剂CB-839是一个这样的候选药物。许多癌细胞可对谷氨酰胺上瘾,谷氨酰胺可分解成各种用途的谷氨酸。谷氨酰胺酶1(GLS1)控制谷氨酰胺水解成谷氨酸,而谷氨酸可以看作是细胞利用氨基酸能力的瓶颈。通过阻断谷氨酰胺酶1(GLS1),Calithera公司的CB-839迫使癌细胞快速戒除谷氨酸盐。
虽然健康的组织也可将谷氨酰胺转化为谷氨酸,但这个过程是由两个蛋白促成的:GLS1和GLS2。通过选择性地只抑制GLS1,位于肝脏的GLS2可以维持非癌细胞的氨基酸整体平衡。中枢神经系统是GLS1发挥重要作用的另一个地方,但CB-839不会穿透到中枢神经系统,谷氨酰胺在神经传递中的作用未被触及。尽管谷氨酰胺代谢有广泛的重要性,但安全性和治疗窗都不是问题。
然而,在病人的选择策略方面存在很大的问题。在缺乏遗传生物标志物的情况下,该如何确定哪些患者人群最有可能受益,从而如何取得上市批准?
Calithera公司正处于患者选择标志物发现的最终阶段,公司已经将其主要焦点缩小至肾细胞癌(RCC)和三阴性乳腺癌(TNBC)。另外,大肠癌和肺癌也是公司的关注领域。
2017年该公司计划开始Ⅱ期临床试验,将在肾细胞癌(RCC)患者中通过mTOR抑制剂依维莫司修复CB-839。肾细胞癌(RCCs)患者通常携带导致假性缺氧环境的基因突变,进而增加对谷氨酰胺代谢的依赖。当CB-839用于关闭谷氨酰胺酶的产生时,临床前数据表明,饥饿的癌细胞可关闭mTOR途径,从而可减缓其增殖率。通过使用依维莫司修复CB-839,Calithera公司计划加倍重视mTOR的漏洞。
在三阴性乳腺癌(TNBC)的Ⅱ期试验中,将针对对紫杉烷有抗性的患者使用紫杉醇修复CB‑839。三阴性乳腺癌(TNBC)是一种特别的代谢性疾病,并且经常涉及氨基酸代谢途径的负转录调控和GLS1表达。初步的临床数据表明,CB-839可诱导之前对紫杉烷类药物没效果患者的反应。
大约1/3的CB-839研发项目见证了研究者关于癌症代谢思维方式的转变。研究表明,代谢产物不仅对癌细胞是重要的,对于还驻留在肿瘤微环境中的免疫细胞也同等重要。
在CB-839的研究中,谷氨酰胺对于癌症杀伤性T细胞的激活至关重要。通过阻断肿瘤细胞中谷氨酰胺的代谢途径,Calithera公司希望增加在肿瘤微环境中的氨基酸水平,以便为免疫细胞提供营养。Calithera公司正试图将候选药物与百时美施贵宝公司研发的候选药物nivolumab进行复方。Nivolumab以细胞程序性死亡蛋白1(PD1)为靶向,目前处于Ⅰ/Ⅱ期试验中,评估该药在治疗肾细胞癌(RCC)、黑色素瘤和非小细胞肺癌过程中的免疫推动作用。第一批数据将于2017年的美国临床肿瘤学会年会公布。
有学者认为,这个领域对T细胞的代谢研究情有独钟,因为较易研究、机制新、与众不同、易于上手。癌症代谢研究领域的界限是模糊的。在某些情况下,如在CB-839项目中,研究人员研究对于癌症和免疫细胞生存至关重要的代谢产物。在其他情况下,他们的重点是影响微环境中肿瘤细胞和免疫细胞之间相互作用的代谢产物,即使它们不直接产生或被癌细胞所利用。例如,吲哚胺-2,3-双加氧酶1(IDO1),可在免疫细胞中氧化色氨酸,并产生免疫抑制代谢产物犬尿氨酸,而色氨酸是饥饿的免疫细胞所需的氨基酸。Incyte公司的IDO1抑制剂epacadostat旨阻断其在肿瘤微环境中这种效果,从而提高免疫系统杀灭癌细胞的能力。其他一些免疫代谢药物也已经进入临床试验阶段(表2)。
研究者认为这是一个令人难以置信的令人兴奋的领域。
Agios公司和其他一些研究机构也将转向筛选合成致死性化合物的研究,作为找出以便进一步研究的遗传性质明确、可作为药物靶向的癌症代谢指标的一种手段。虽然基因组分析没有更多地获取到功能获得性的代谢突变,但是已经可以找出大量代谢途径缺失性和功能丧失性的突变。当这些损失迫使癌细胞建立一种对补偿途径的依赖时,将可以为药物研发者们提供机会。
相关学者指出,研究的目标不是肿瘤抑制基因的缺失;而是因缺失导致肿瘤变得脆弱的另一条途径。多聚(ADP-核糖)聚合酶(PARP)抑制剂,对于BRCA基因缺陷是综合致死性的,研究证明这条途径可作为药物靶向。今年早些时候,有研究指出,MTAP编码的代谢酶的缺失可导致三种酶产生缺陷。基于多种原因,目前研究者还没有找到这一途径中合适的靶向,但他们对这一途径充满信心。
2013年成立的生物技术公司Metabomed公司通过筛选化合物,建立靶向代谢列表。2016年初,Metabomed公司引进1800万美元的投资。研究者认为找到目标代谢以及降低毒性最有效的方法,是找到遗传性质明确、代谢功能丧失的酶,这样可导致对其他代谢酶的高度依赖,从而建立靶向。
癌症代谢研究领域还很年轻,在有能力提供源源不断的药物之前还有很长的路要走。这一领域如何发展没有明确的答案,甚至没用明确的未来,但现在摆在面前的是大量的工作。
(编译作者:王欣伊)