7月4日,广东省发布了2016年第11号撤销GSP认证证书公告。至此,今年广东省已经撤销了18家企业的GSP认证,其中绝大多数是批发企业(15家)。
此外,限期整改的公告也发到了第5号,一共涉及78家企业,同样以批发企业为主(62家)。
批发企业篇
批发企业被公布的不符合GSP的项目一共达到152条,涉及约70条检查项目。这些项目在《GSP现场检查细则》中分布见图1。
1.严重缺陷项目:撤销GSP认证的主因。
在《GSP现场检查细则》中,药品批发企业的检查项目一共有6个严重缺陷项目(**)。这些项目一旦发现有问题,就是“一票否决”,直接撤销GSP认证。
这么严重的问题,企业应该特别关注。但事实上,这15家被撤销GSP认证的批发企业中,有8家企业违反“药品经营企业应该依法经营”,或超范围经营,或非法设仓;有5家企业违反“药品经营企业应当坚持诚实守信,禁止任何虚假、欺骗行为”,基本上造假被查,后果比缺漏严重;还有5家企业违反“企业销售药品应当如实开具发票,做到票、账、货、款一致”。
可见,违反严重缺陷项目(**)是被撤销GSP认证的最主要原因。
2.质量管理相关问题多。
《GSP现场检查细则》中涉及质量管理的检查项目很多,从“质量管理体系”“机构和质量管理职责”“人员与培训”到“质量管理体系文件”等。GSP飞检查出来的药品批发企业质量管理相关的问题非常多,一共有36条不符合GSP的项目,约占28%,主要分布见图2。
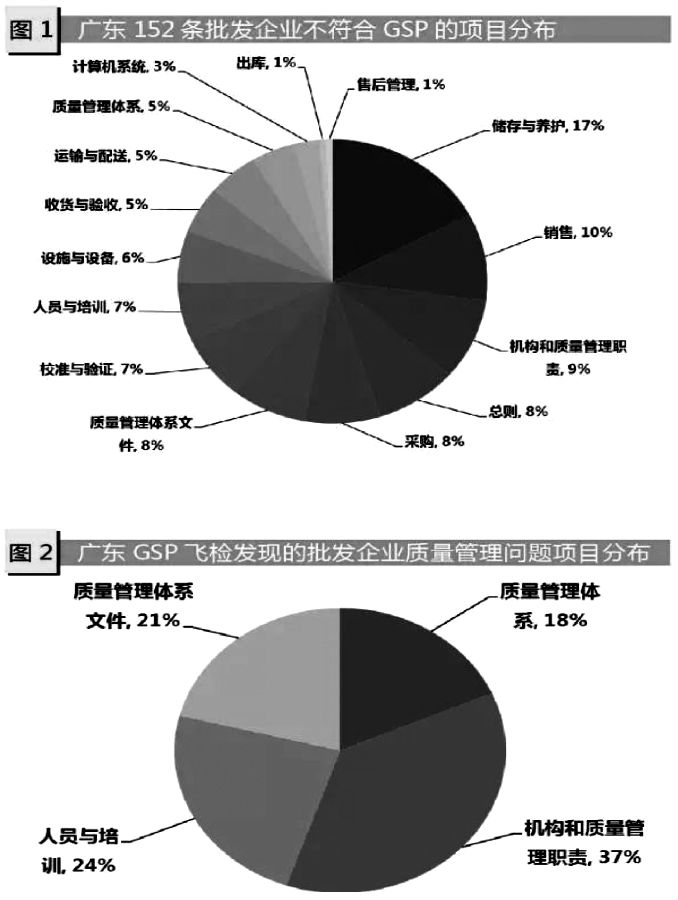
其中,关于质量管理职责的检查项目很多,达18条,有7条是主要缺陷项目(*)。但公告中一般不会详细描述每项职责的情况,而是表述为“质量管理部门未能有效开展质量管理工作,未能有效履行质量管理部门的职责”,在所有公告的批发企业中,有7家企业被查出此问题。
此外,“公司负责人未能提供必要的条件,保证质量管理部门和质量管理人员有效履行职责”以及“质量负责人未能在企业内部对药品质量管理实施裁决权”,是“机构和质量管理职责”中常被单列出来的问题,在所有公告的批发企业中,违反上述两个项目的分别有2个和5个。
质量管理相关问题中被查出较多的另一类问题在“人员与培训”中,如“企业质量负责人不在职在岗”“质量管理部门人员是兼职人员”等(有7家企业被查出),又如“企业质量负责人执业药师注册证已过期,未重新办理注册”(有2家企业被查出)等。
“质量管理体系”中容易被查出的问题主要集中在内审。《GSP现场检查细则》中要求两种情况企业要组织内审:在质量管理体系关键要素发生重大变化时,以及定期内审。公告分别有3家批发企业为前一种情况没有组织内审,4家批发企业没有定期内审。
“质量管理体系文体”中容易被查出的主要缺陷项目(*),是关于各种记录的完整性与准确性等问题。公告的批发企业中,有3家企业被查出此问题。此外,有6家企业被查出“企业未定期审核、修订文件”,这属于一般缺陷项目。
3.另一个“雷区”:温湿度、冷链。
温湿度、冷链相关的检查项目相当多,从设施设备,到人员的行为,再到文件记录等,而且这些检查项目大多数是主要缺陷项目(*)。
例如相关设施设备,主要是指冷库、储运温湿度监测系统、冷藏运输有没有配备,配备得与经营规模是否相适应,能不能正常使用,有没有使用等,以及这些设施设备有无定期验证——这一点非常容易出问题。所有公告中的批发企业,有10家被查出这些设施未进行定期验证。
人员的行为方面,主要是养护人员,需要对库房温湿度进行有效监测,所有公告的批发企业中,有3家被查出违反此项目。
文件记录方面,则是查看有没有记录,是否完整、真实等。
4.储存与养护:分类存放最易被查。
在所有公告中,违反GSP要求的项目中,关于“储存与养护”的有26个,其中分类存放方面有10个:主要是药品与非药品未分开存放(8个),以及中药材和中药饮片未分库存放(2个)。这两条均属于主要缺陷项目(*)。
此外,关于不合格品的处理也被查出较多问题。其中7家企业被查出“不合格药品处理过程没有完整的手续和记录”,以及1家企业被查出“不合格药品专用场所不符合要求”。
剩下的关于温湿度方面问题的有7家企业违反,关于特殊管理的药品储存问题有2家企业违反。
5.销售:发票与购货单位合法性。
在所有公告中,违反GSP要求的项目中,关于“销售”的有15个,主要集中在三个方面:一是发票,属于严重缺陷项目(**);二是购货单位的合法性问题——有6家企业被查出“将药品销售给不具备合法资格的单位”或“未对采购单位的采购人员真实性进行审核”;三是关于特殊管理的药品以及国家有专门管理要求的药品的销售,有4家企业被查出这方面没有严格按照国家相关规定执行。
6.采购:首营的审核是重点。
所有公告中,违反GSP要求的项目中,关于“采购”的也有12个。其中关于首营的(有没有做首营审核,审核是否规范)就有10个。剩下2个则是“采购部分药品未向供货单位索取发票”。
7.收货与验收:电子监管码还得扫。
在8个违反GSP“收货与验收”的项目中,有6个均是违反“对实施电子监管的药品,应当按规定进行药品电子监管码扫码,并及时将数据上传至中国药品电子监管网系统平台”。
所以,即便CFDA取消了2015年1号文中相关条款,但在GSP飞检中,依然会检查电子监管码的实施情况——至少广东省在6月下旬的飞检中依然查出了此问题。
零售企业篇
通过加强监管,提高行业门槛,淘汰落后产能,是医药行业各领域目前的主旋律。而在药品零售领域,GSP飞检进入常态化并扩散到零售领域,就是目前整个行业最为紧张的地方。
那么,零售领域的GSP飞检容易查出哪些问题呢?
笔者整理了广东省2016年上半年公布的GSP飞检发现的问题,发现以前觉得容易出问题的,如药师不在岗、票据等问题根本没有出现。那么,到底是什么地方容易出现问题?
⒈分类存放。
“分类存放“的确是个常见问题,而且涉及好几种情况!
在《GSP现场检查细则》的检查项目中就包括:处方药与非处方药的分区陈列、非药品专区与药品明显隔离、外用药品与其他药品分开摆放、中药饮片专库存放等要求。
2.质量管理。
“质量管理”也是飞检中很容易发现问题的领域。
在许多飞检结果的公告中,对不符合GSP要求的描述中经常会出现“质量管理部门未按要求履行规定职责”的话。实际上,在《GSP现场检查细则》的检查项目中,药品零售企业的“质量管理与职责”有19个检查项目,其中严重缺陷项(**)1个,主要缺陷项(*)7个。这当中质量管理部门或质量管理人员的职责就有15条,涉及企业经营的方方面面。
在“人员管理”中,还对质量管理人员的从业资格做出要求:具有药学或者医学、生物、化学等相关专业学历或者具有药学专业技术职称;“文件”中要求:企业应当对质量管理文件定期审核,及时修订。
此外,因为药品零售连锁企业总部及配送中心是要按照药品批发检查项目检查的,其中有更多“质量管理体系”的检查项目。例如关于内审的:企业应当定期开展质量管理体系内审,以及在质量管理体系关键要素发生重大变化时,组织开展内审——这些都是主要缺陷项(*)。
3.未在核准注册地址。
其实,这并不是那么容易出现问题的方面,但还真有这样的情况出现,而且一旦出现就是严重缺陷项(**),直接撤销GSP牌照了。
而且,这一条出现问题往往是“注册地址在1楼,实际经营在1、2楼”这类情况。也许因此被查会让人觉得很冤,但哪怕是这样,也是“未在《药品经营许可证》核准的注册地址经营药品”。
4.温湿度。
温湿度问题在公布出来的GSP飞检结果中非常常见。
《GSP现场检查细则》中关于温湿度的检查项目相当多。从“文件”、“设施与设备”、“采购与验收”到“陈列与储存”均有涉及,而且大多数属于主要缺陷项(*)。
所以,千万不要觉得有冷链产品的才需要注意温湿度问题。
而且别忘了,药品零售连锁企业总部及配送中心按照药品批发检查项目检查时,里面涉及温湿度的检查项目更多。
5.电子监管数据。
虽然今年初CFDA取消了2015年1号文中电子监管码的相关内容,但“对实施电子监管的药品,应当按规定进行药品电子监管码扫码,并及时将数据上传至中国药品电子监管网系统平台”依然是《GSP现场检查细则》的检查项目——例如广东省今年4月的一次检查中依然有连锁因此被要求限期整改。
(注:此文中“所有公告”均指今年以来截至7月5日广东省食品药品监管委员会撤销GSP认证证书和GSP限期整改公告。)
(选自《医药经济报》)