FDA在2003 年批准了首个作用于细胞垃圾处理系统,即泛素-蛋白酶体系统的药物Velcade (硼替佐米),该药用于治疗多发性骨髓瘤(一种血液系统恶性肿瘤)。2004 年,三位科学家凭借对泛素-蛋白酶体系统的研究而共同获得诺贝尔化学奖。泛素-蛋白酶体系统接二连三的喜讯极大地鼓舞了该领域研究人员,但此后的研究并没有更大的突破性进展。
泛素-蛋白酶体系统的药物开发靶点
蛋白酶体吸引药物开发者的是:其主要功能是降解无用的,错误折叠的,或已被破坏的蛋白质。这对于维持细胞正常的生理活动是必需的。许多疾病的发生都与蛋白酶体系统异常有关,如癌症,神经疾病和炎症。蛋白酶体系统相当精巧。就结构而言,真核生物的26S蛋白酶体(以主要成分的沉降系数命名)包含一个20S的催化亚基,及一个或两个19S调节亚基。20S核心复合物形成了一个桶状结构,含有4个堆积环,每个含有7个亚基,围绕着中央的空腔。外环含有失活的α亚基,相当于一个门。Β亚基的催化位点向着环的内侧,负责降解蛋白质。
蛋白质的降解是一个高度受控的过程。泛素分子是一个由76个氨基酸组成的保守蛋白。蛋白质需要通过三步来泛素化。泛素先从E1泛素活化酶转移到E2泛素共聚酶(有十几个这样的酶),再通过与E3泛素连接酶(有数百个这样的酶)的相互作用,最终将泛素转移到蛋白质上。另一层调控来自于去泛素化酶。这类酶是将泛素从蛋白质上移除,因此防止了蛋白质被蛋白酶体的识别。大约有20个泛素样蛋白(结构与泛素类似的蛋白)通过一系列相互关联的通路来调控多种细胞过程。具体来说,泛素传递其死亡之吻之前,E1、E2两个酶首先使其进入粘附预备状态,另外一个酶E3则起加速粘附作用,根据生物学中最早的命名方式,E代表酶,其后的数字代表泛素通路级联反应步骤和次序。首先E1粘附于泛素的半胱氨酸残基活化位点,使标记蛋白活化并转运至E2泛素共聚酶的半胱氨酸上,至此,在装载着泛素的货船上,E2与E3泛素连接酶结合,之后,E3作为一个中介子,结合蛋白底物并协助从E2转运泛素至底物上。能把泛素从底物上去掉的酶称为去泛素化酶,一些有此功能的蛋白可能被开发成为药物作用靶点,但要实现却也并非易事。
泛素的活化需要三磷酸腺苷(ATP),ATP位于E1的ATP结合部位,该部位是一个很好的药物作用靶点。FDA批准用于治疗慢性骨髓性白血病的Imatinib(gleevec)就属于这类药,该激酶通过占据靶点的ATP结合位点而发挥作用。以E1为靶点的药物可能不具有很高的特异性,在一种特定细胞中,E1 含量极少,不同种类E2含量较多而E3含量非常大,每个E1都参与多种细胞通路,因此,一个E1失活可能导致其它通路受阻,产生副作用。
有人认为E1位于上游太远端,在其之后可能还会有很多生物级联反应,因此不是一个很好的作用靶点,但也有人认为对于肿瘤学来说却可能恰如其分,因为可以同时关闭多重通路。有专家相信在泛素通路更下游端的E3可能更具有特异性,一般认为每个E3仅对少数几种底物有响应,且许多E3都与心脏病发作等特定疾病相关。通过靶向E3,使一些蛋白降解发生改变的药物极具开发潜力。但目前研究人员仍对E3所知甚少,仅知道E3与E2 相互作用,但两者相互作用的过程如何还不清楚,E2/E3复合物的X射线晶体结构也只提供了一些蛛丝马迹,而且,迄今为止发表的结构图中并没有出现泛素这个关键部分。一般来说,针对蛋白质-蛋白质相互作用的药物很难具有特异性,抑制E3涉及的蛋白质-蛋白质相互作用也不例外。
制药者可能对E3了解甚少,但对另一个通路——去泛素化酶(DUBs)却再熟悉不过了,DUBs能使E3粘附的泛素去除,从而为研究E3相关途径提供了另一个入口。DUBs可能是一个更易于处理的药物靶点,DUBs属于半胱氨酸蛋白酶,对它的研究和了解也都已经比较深入和全面。阻断DUBs催化活性要比阻断蛋白质-蛋白质相互作用容易得多,研究人员目前正对其催化活性进行分析。目前,已有有靶向DUB 的药物进入临床试验阶段。
蛋白酶体抑制剂并非一个利器,它们对众多通路都有影响但可能仅对一个或两个通路造成破坏,因此,很多研究小组都在试图开发新一代蛋白酶体抑制剂,或关注蛋白酶上游即泛素粘附目标蛋白阶段,以期发现更多治疗靶位。
附表: 部分以泛素-蛋白酶体为靶点的已上市或正在开发的药物
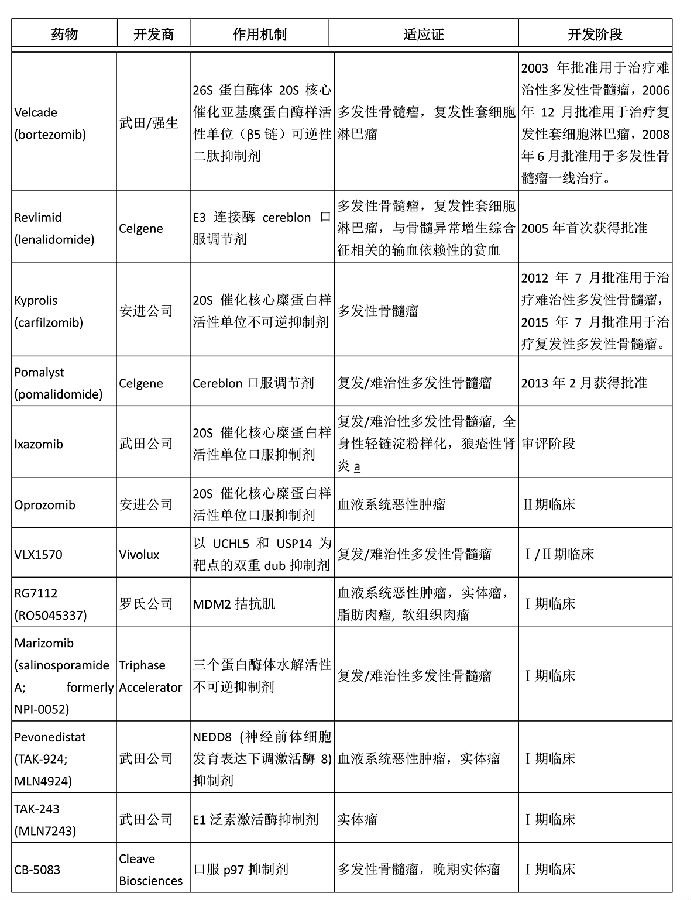
新开发的以泛素蛋白酶体系统为靶点的药物
由于泛素-蛋白酶体系统的复杂性,理论上有多个位点可供药物进行干预。但至今药物开发者们只在少数几个位点获得成功。Velcade和Kyprolis (carfilzomib)都以20S催化核心的糜蛋白酶样活性(β5)为靶点。这些药物实际上是β5抑制剂,而非蛋白酶体抑制剂。令人不解的是,泛素-蛋白酶体靶向药物对多发性骨髓瘤效果显著,但却没有证据显示这类药对其他癌症也有效。一个可能的解释是这些药物只能关闭大约50%的总蛋白酶体活性,对于多发性骨髓瘤,50%的抑制率应该足够了。因为多发性骨髓瘤产生大量的免疫球蛋白,由于过量蛋白的堆积,瘤细胞对于蛋白毒性休克非常敏感。而对于一般的实体瘤,需要更高的抑制率,而且作用时间要更长。
Velcade和Kyprolis的治疗窗口都比较窄,有较严重的副作用,如外周神经系统毒性。已进入Ⅲ期临床开发的武田公司的ixazomib具有更好的生物利用度,因此可一定程度提高治疗指数,但仍需要更长时间给药。武田公司已经制定了广泛的开发计划,其中包括了以高水平蛋白产生为特征的实体瘤。
Revlimid (lenalidomide)和相关的萨利多胺类似物(归类为免疫调节药物)的作用机制最近几年才被人了解。它们通过结合一种称为cereblon 的E3泛素连接酶而起作用。最近,Celgene公司的科学家的研究显示这类药物可以提高两个免疫抑制转录因子ikaros和aiolos泛素化水平和降解,从而加强T细胞反应。
这是一个重大发现,因为药物化学家一直以来在靶向E3泛素连接酶时都遇到困难。由于E3泛素连接酶对蛋白底物具有特异性,因此如果以该酶作为靶点,则可使药物比一般的蛋白酶体抑制剂具有更高的选择性。细胞内存在四类E3泛素连接酶,包括E6-AP羧基端结构域同源蛋白(HECT),U-盒蛋白,RING指E3泛素连接酶和多亚基E3复体(包含一个RING指蛋白)。这些酶的功能大部分都是未知的。
另一个药物开发者要面对的难题是E3连接酶更像一个“适应子蛋白(adaptor protein)”,而不是酶,E3连接酶并没有活性位点,而是靠蛋白-蛋白相互作用而实现其功能。另外,E2泛素共聚酶也是一个困难的靶点,该酶并不具有深的口袋样或沟槽样结构,具备这样的结构一般有利于小分子化合物的结合。该酶的活性位点属于暴露性位点,因为泛素的羧基端需要和该酶结合,同时该酶还需要和底物的赖氨酸残基反应,因此暴露性的活性位点有利于这些功能,但却不利于小分子化合物结合。
Celgene公司希望能借助于位于旧金山的Nurix公司的结构生物学技术来寻找可以靶向E3泛素连接酶或E2泛素共聚酶的小分子化合物。两家公司的交易包括1.5亿美元的头期款以及高达4.05亿美元/项目的阶段性付款。
癌症仍然是开发者关注的适应证,但炎症和神经变性疾病也是潜在的适应证。去泛素化蛋白也是一类可利用的靶点,目前已鉴定了5个大类,超过70种酶属于这一家族,包括4个半胱氨酸蛋白酶家族,泛素C末端水解酶,泛素特异性蛋白酶(USPs),Machado-Joseph病蛋白结构域蛋白酶,卵巢肿瘤蛋白酶和JAMM结构域金属蛋白酶家族。位于英国剑桥的Mission Therapeutics致力于前4个蛋白酶家族靶点的开发。而Almac公司和基因技术公司的价值3.635亿美元的交易则关注一个尚未批露的USP癌症靶点。(编译作者 樊小军)